Kā tiek veidotas olbaltumvielu struktūras |
|
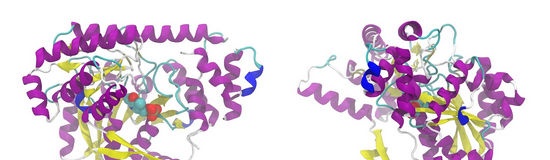
Bioloģisko struktūru, to sastāva un molekulārās organizācijas, to specifiskās aktivitātes izpēte ir kļuvusi par molekulārās bioloģijas priekšmetu. Pēdējo panākumi galvenokārt ir saistīti ar nukleīnskābju struktūras atšifrēšanu un iedzimtas informācijas raksturu. Nukleīnskābes molekula ir četru veidu nukleotīdu lineāra secība, kas sakārtota sarežģītā, bet stingri noteiktā secībā un ko var salīdzināt ar burtu regulāru izvietojumu jēgpilnā tekstā. Tāpat kā teksts nes kādu vēstījumu, kādu informāciju, nukleotīdu secība nukleīnskābes molekulā satur informāciju par olbaltumvielu atsevišķajām struktūrām, kas jāizveido organisma veidošanas procesā. Olbaltumvielu molekula ir arī lineāra strukturālo elementu secība, bet ne nukleotīdi, bet divdesmit aminoskābju veidi. Katra trīs nukleotīdu kombinācija nukleīnskābes molekulā (ģenētiskais kods) nosaka vienas vai otras no divdesmit aminoskābēm iekļaušanu. Nukleotīdu tripletu secība nosaka precīzu aminoskābju secību sintezētajā olbaltumvielu molekulā. Turpinot jau vispārpieņemto ģenētiskās informācijas salīdzinājumu ar rakstīto tekstu, mēs varam teikt, ka olbaltumvielu sintēzes laikā nukleotīdu valodā rakstītais teksts tiek tulkots aminoskābju valodā. Informācija, kas ietverta noteikta veida olbaltumvielu aminoskābju tekstā, tas ir, tikai tai piemītošo aminoskābju sastāvs un secība, nosaka tās formu un smalko iekšējo organizāciju - strukturālo elementu telpisko sakārtotību, uz kuriem noteikti tā elementi bioloģiskās funkcijas ir atkarīgas. Ja šī kārtība ir traucēta, piemēram, fermentu olbaltumvielas zaudē spēju katalizēt reakcijas organismā. Pētījumi ir parādījuši, ka noteiktas olbaltumvielu funkcijas tieši veic ķīmisko grupu asociācijas, kas atrodas noteiktās sakārtotas olbaltumvielu molekulas daļās - specifiski funkcionālie centri. Kad kārtība tiek izjaukta - piemēram, olbaltumvielu molekula kūst -, tad ķīmisko grupu kombinācijas iegūst iespēju mainīt savstarpējo izvietojumu, izkaisītie un funkcionālie centri vairs nepastāv. Tādējādi nukleotīdu valodas tulkojums aminoskābju valodā nav tikai tulkojums. Aminoskābju burti ir daudz bagātāki ar fizikālo un ķīmisko saturu nekā nukleotīdu burti. Kopumā informācija, ko satur olbaltumvielu molekula, būtiski atšķiras no informācijas par nukleotīdiem, jo tā nosaka olbaltumvielu molekulu uzbūves specifiku un to vissīkākās bioloģiskās funkcijas. Tehniskajā jomā ir vēl viens salīdzinājums. Nukleīnskābēs ietvertā informācija ir kā rasējumi, no kuriem detaļas tiek izgatavotas un samontētas noteiktā secībā. Olbaltumvielu molekula ir samontēts mehānisms, un tā aminoskābju secībā esošā informācija ir paša mehānisma programma. Dzīvā šūnā lielākā daļa olbaltumvielu darbojas nevis brīvā stāvoklī, bet gan kā sarežģītu struktūru sastāvdaļas - labi līdzsvarotas un kontrolētas sistēmas, kur katram proteīnam ir noteikta vieta un noteikta daļa kopējā, jau fizioloģiskajā funkcijā. Šūnu sarežģītu struktūru uzbūve ir dialektiska pāreja no ķīmijas jomas (kurai jāietver atsevišķu olbaltumvielu molekulu darbība) uz bioloģijas jomu. Kompleksās bioloģiskās struktūras papildus olbaltumvielām satur arī lipīdus, ogļhidrātus un citas vielas.Tomēr, veidojot sarežģītas intracelulāras struktūras, šo vielu loma nav vadošā. Pēc ķīmiskās struktūras pēc būtības ogļhidrāti un lipīdi vienkārši nevar saturēt tik lielu informācijas daudzumu, kas nepieciešams šādai konstrukcijai. Vissvarīgākā loma tajā ir specifiskām olbaltumvielām. Tādējādi mūsdienu molekulārā bioloģija apstiprina un sīki izklāsta F. Engelsa labi zināmo nostāju par olbaltumvielām kā dzīves pamatu. Olbaltumvielās, kur bezgalīgi dažādas molekulas tiek veidotas no struktūras elementiem ar ļoti atšķirīgām īpašībām, kur unikālas organizācijas precizitāte tiek apvienota ar elastību un plastiskumu, daba ir atradusi ārkārtas materiālu, kas ļāva izveidot augstāku, bioloģisku kustības formu no matērijas. Konkrētu centru klātbūtne ir kopīga olbaltumvielu īpašība, kas veic specializētas bioloģiskās funkcijas. Tie ir olbaltumvielu molekulu "darba orgāni". Pateicoties īpašiem specifiskiem centriem, fermentu proteīni selektīvi saista vielas, kuru ķīmisko pārveidojumu katalizatori ir antitoksīna proteīni, saista toksīnus utt. Saskaroties tiek organizēta mijiedarbības sistēma starp noteikta centra un partnera molekulas ķīmiskajām grupām. Tajā ietilpst, pirmkārt, elektrostatiskā pievilcība starp grupām ar pretēju elektrisko lādiņu; otrkārt, tā sauktās ūdeņraža saites starp elektriski polārajām grupām; un, visbeidzot, treškārt, "hidrofobās" saites - mijiedarbība starp nepolārām grupām (grupām, kuras atgrūž ūdens). Parasti stabilas ķīmiskās saites šeit nerodas, jo katra atsevišķi uzskaitītā mijiedarbība ir diezgan vāja. Bet kopumā konkrēta centra sistēma nodrošina pietiekamu molekulu savienojuma stiprumu. Iepriekš minētā specifisko centru darbības selektivitāte tiek panākta, pateicoties ķīmisko grupu sastāva un izvietojuma atbilstībai pašā centrā un partnera molekulā - tā sauktajai komplementaritātei. Jebkura grupu aizstāšana vai pārvietošana nozīmē papildinošā ™ pārkāpumu. Ir arī skaidrs, ka īpašs centrs ir ne tikai darba mehānisms, bet arī šifrs, kas ļauj olbaltumvielu molekulai “atpazīt” savu partneri starp daudzām citām molekulām, pat tām, kurām ir liela līdzība ar šo partneri. Konkrētu centru jēdziens atspoguļo tikai olbaltumvielām raksturīgo funkcionālo mehānismu vispārējo raksturu. Olbaltumvielu īpašās funkcijas, to specifisko centru struktūra un reakcijas joprojām ir zinātnes joma, kurā gandrīz viss ir darāms. Tas attiecas arī uz supramolekulāro bioloģisko struktūru veidošanās procesiem. Dažas bioloģiskās struktūras ir ārkārtīgi sarežģītas. Tādas ir, piemēram, membrānas ar * enzīmu kompleksiem. Šādu struktūru montāžu veic, kā liecina citu pētījumu dati, lielā daudzu olbaltumvielu komponentu sistēmā.Daudzu olbaltumvielu dalība šajā darbā acīmredzot ir tikai netieša - tās piedalās tikai struktūras izveidošanas procesā, bet nav iekļautas tās sastāvā. Tiek pieņemts, ka starp šiem papildu proteīniem ir specifiski fermenti. No otras puses, ir bioloģiskas struktūras, kurām ir salīdzinoši vienkārša struktūra. Piemēram, citas šķiedru struktūras tiek veidotas no tikai viena veida olbaltumvielu molekulām. Dažos gadījumos laboratorijās ir iespējams sadalīt vienkāršas bioloģiskās struktūras to atsevišķos elementos - olbaltumvielās un citās molekulās. Atbilstošos vides apstākļos šie elementi atkal tiek apvienoti pareizajā secībā un atjauno sākotnējo struktūru. Šo atjaunošanas procesu parasti sauc par pašsapulci. Vairākas pētnieku grupas gan ārzemēs, gan mūsu valstī pēta tā mehānismus. Viena no šādām grupām ir Bioķīmijas institūta Olbaltumvielu struktūru un funkciju laboratorija, kurā tiek pētīta fibrīna šķiedru pašsavienošanās. Labvēlīgos apstākļos ķermenim asinīs, kas cirkulē caur neskartiem traukiem, ir šķīstošs fibrīna prekursors - olbaltumvielu fibrinogēns. Kad tiek bojāti asinsvadi, īpaša sarežģīta olbaltumvielu sistēma sāk ražot fermentu trombīnu, kas no lielas fibrinogēna molekulas sašķeļ četras mazas daļiņas, ko sauc par fibrīna peptīdiem. Zaudējis tos, fibrinogēns pārvēršas par fibrīna proteīnu, kura molekulu polimerizācija (savienojums savā starpā) veido šķiedras. Monomeriskās fibrīna molekulas polimerizējas ar stingru secību, kas raksturīga visiem pašsavienošanās procesiem. Eksperimentāliem pašsavienošanās procesu pētījumiem nepieciešami risinājumi Tāpēc pirmā problēma, kas rodas pirms zinātniekiem, kuri sāk pētīt pašsavienošanās procesus, ir tieši bioloģisko struktūru "demontāža". Katrā atsevišķā gadījumā jāmeklē katrai struktūrai specifiskas darbības metodes, kas efektīvi nojauktu saites starp tās sastāvā esošajiem monomēriem un neradītu nekādu kaitējumu pašiem monomēriem. Fibrīnam ilgu laiku nebija iespējams atrast pilnīgi apmierinošu tā polimēru šķiedru sadalīšanās veidu. Sākotnēji šim nolūkam piedāvātie urīnvielas un pēc tam nātrija bromīda šķīdumi bija neefektīvi. Tikai 1965. gadā mūsu laboratorijas TV Varetskaya darbinieks izstrādāja metodi, kas pilnībā atbilst visām prasībām, pamatojoties uz atšķaidītu etiķskābes šķīdumu lietošanu temperatūrā, kas tuvu 0 ° C. Šādā veidā iegūtajām monomēra fibrīna molekulām vienmēr ir vienādas īpašības, kas pavairotas no eksperimenta uz pieredzi. Iepriekšējās fibrīna sadalīšanās metodes urīnvielas vai nātrija bromīda šķīdumos nedeva šādu īpašību noturību: dažādi ar to palīdzību iegūtā monomēra proteīna paraugi atšķīrās, piemēram, ar dažādiem polimerizācijas ātrumiem. Interesanti, ka tad, kad citu olbaltumvielu - mitohondriju strukturālo olbaltumvielu - iegūst izšķīdušā stāvoklī, labākos rezultātus (kā secinājuši amerikāņu zinātnieki, pētot šo struktūru pašsapulci) iegūst arī atdzesēts atšķaidīts etiķskābes šķīdums. Procesi, kas saistīti ar struktūru pašsastāvēšanu, tiek pētīti dažādos veidos.Viens no šiem veidiem ir sistemātisks dažu vielu procesa norises ietekmēšanas rezultātu izpēte. Piemēram, fibrīna polimerizācijas kavēšanos var izraisīt, ja sākotnējo monomēra šķīdumu pakļauj neorganisko sāļu, īpaši nātrija hlorīda, ūdens šķīdumam. Zemas sāls koncentrācijas robežās - līdz 2-3% - polimerizācijas kavēšanās ir spēcīgāka, jo "spēcīgāks" šķīdums. Kādu informāciju sniedz šis fakts? Ir zināms, ka sāļi ūdens šķīdumā pastāv jonu formā, kuriem ir pozitīvi un negatīvi elektriskie lādiņi. Sāls jonu elektrostatisko efektivitāti parasti novērtē ar īpašu vērtību - jonu stiprumu, kurā tiek ņemta vērā šķīduma koncentrācija un tā jonu lādiņa lielums. Atsevišķu sāls jonu ķīmiskajam raksturam šeit nav nozīmes. Polimerizācijas kavēšanos galvenokārt nosaka sāls šķīduma jonu stiprums, kas pievienots monomēriskajam olbaltumvielu šķīdumam. Tas parāda, ka ietekme galvenokārt ir elektrostatiska. Acīmredzot sāls joni pārbauda ("dzēš") monomēru fibrīna molekulu elektriskos lādiņus - apstāklis, kas tikai norāda, ka to elektriskie lādiņi ir iesaistīti olbaltumvielu molekulu selektīvā savienojuma mehānismā. Normālos apstākļos - ja nav elektrostatiski uzlādētu sāls jonu iejaukšanās - pozitīvi un negatīvi lādētām jonu grupām, kas komplementāri atrodas noteiktos centros, vajadzētu piesaistīt molekulas viena otrai. Detalizētāki pētījumi, ko mūsu laboratorijā veica EV Lugovskii, parādīja, ka līdzās vispārējam jonu stipruma skrīninga efektam ir vēl viens sāļu efekts, kas lielā mērā ir atkarīgs no jonu ķīmiskā rakstura un individualitātes un ko nosaka to spēja pievienoties olbaltumvielai. Jona piestiprināšana konkrētam centram acīmredzami ievieš papildu traucējumus tā darbā. E. V. Lugovskii pētīja augstākas sāls koncentrācijas ietekmi uz polimerizāciju. Izrādījās, ka daži sāļi strauji aizkavē, bet citi, gluži pretēji, paātrina polimerizāciju. Tā, piemēram, divi radniecīgi sāļi, nātrija hlorīds un bromīds, darbojas pretēji: pirmais paātrina, bet otrais kavē procesu. Tāpat kā bromīds, bet vēl spēcīgāk, nātrija jodīds darbojas tāpat kā hlorīds ar dažādu stiprumu - dažreiz stiprāku, tad vājāku - darbojas sulfāti, fosfāti un daži citi sāļi. Izrādījās, ka, pateicoties fibrīna polimerizācijas paātrinošās iedarbības spēkam, sāļi tiek sakārtoti rindā, kas sakrīt ar sen izveidoto un labi zināmo rindu olbaltumvielu "sālīšanai" (nogulsnēšanai) šķīdumos ar augstu sāls koncentrāciju. Tomēr eksperimentos ar fibrīna polimerizāciju īsta sālīšana vēl nenotiek, jo process tiek pētīts sāls koncentrācijā, kas joprojām nesasniedz sālīšanu. Turklāt, sālot, olbaltumvielas tiek nogulsnētas bezveidīgas masas formā, un aprakstītajā gadījumā izveidojās normālas fibrīna šķiedras - tās varēja redzēt, izmantojot fāzes kontrasta mikroskopu. Daudzi pētījumi ir atklājuši, ka olbaltumvielu tieksmi uz sālīšanu pastiprina nepolāru grupu klātbūtne molekulu tuvumā tās virsmai un saskarē ar vidi. Jo vairāk šādu grupu, jo zemāka ir fizioloģiskā šķīduma koncentrācija, kas ir pietiekama olbaltumvielu sālīšanai. Šīs labi zināmās pozīcijas var izmantot, lai izskaidrotu mūsu eksperimenta rezultātus, kurā, bez šaubām, izpaužas sālīšanas efekts, norādot, ka monomēra fibrīna molekulas uz tās virsmas jābūt lielam skaitam nepolāru grupu. Bet mums nav īstas sālīšanas. Sālīšanas efekts izpaužas tikai specifiskās polimerizācijas paātrinājumā. To var izskaidrot tikai ar to, ka nepolārās grupas ir olbaltumvielu molekulas noteikta centra papildinošas sastāvdaļas. Tādējādi fizioloģisko šķīdumu ietekmes uz fibrīna polimerizāciju pētījumi parāda, ka fibrīna pašsavienošanās procesā ir iesaistīta gan elektrostatiskā mijiedarbība, gan “hidrofobā” mijiedarbība starp nepolārām grupām. Citu pētījumu dati norāda, ka ir iesaistīts arī trešais mijiedarbības veids starp olbaltumvielu molekulām - ūdeņraža saites. Tagad pievērsīsimies fibrinogēnam, fibrīna priekštecim. Tās molekulas spēj arī polimerizēties, veidojot fibrīnam līdzīgas šķiedras. Tāpēc fibrinogēna monomēriem ir arī īpaši centri. Tomēr to polimerizācijai ir vajadzīgi īpaši apstākļi un jo īpaši liela šķīduma jonu stiprība. Ja elektrisko lādiņu ekranēšana aizkavē fibrīna polimerizāciju, tad, gluži pretēji, tas ir priekšnoteikums fibrinogēna monomēru apvienošanai ķēdē. Bet no tā izriet, ka elektrisko lādiņu izvietojums noteiktā fibrinogēna molekulas centrā ir nelabvēlīgs polimerizācijai un tas jāveic tikai mijiedarbojoties tām ķīmiskajām grupām, kurām nav elektriskā lādiņa. Fibrīna peptīdi, ar kuru šķelšanos fibrinogēna molekula kļūst par monomēru fibrīna molekulu, nes negatīvus elektriskos lādiņus. Acīmredzot to noņemšana ir faktors, kas maina maksas sistēmu noteiktā centrā un rada papildināmību. Interesanti, ka vienu no asiņošanas veidiem, smagu iedzimtu slimību, izraisa fibrinogēna mutācijas izmaiņas, kurās šis proteīns zaudē pozitīvos lādiņus fibrīna peptīdu šķelšanās punktu tuvumā. Pēdējie, tāpat kā parastajā gadījumā, ir sašķelti, bet trombīns vairs neizraisa fibrinogēna aktivāciju (kā redzams diagrammā, aktivizācija sastāv no tā, ka tuvumā esošais noteikta centra pozitīvais lādiņš atbrīvojas no fibrīna neitralizējošās iedarbības. Ja šāda lādiņa nav, fibrīna peptīda šķelšana kļūst bezjēdzīga: aktivācija nenotiek.) Atsevišķiem fibrinogēna vai fibrīna fragmentiem ir raksturīgi defekti specifiski centri, kas tomēr spēj selektīvi mijiedarboties ar monomērisko fibrīnu. Šādus fragmentus var iegūt, iznīcinot šos proteīnus ar fermentiem. Eksperimentos ar viņiem ir viegli novērot, kā aktīvi fragmenti mijiedarbojas ar fibrīnu un izjauc šķiedru montāžu. Tieši ar šādiem eksperimentiem - aktīvo fragmentu ražošanu un izpēti - šobrīd nodarbojas mūsu laboratorija. Cerams, ka, pētot šo fragmentu struktūru un selektīvās reakcijas, mēs labāk sapratīsim, kā paši olbaltumvielas tiek veidoti un darbojas. Jonu grupu komplementaritāte, kurai ir tik būtiska loma fibrīna pašsapulcē, acīmredzot ir svarīga arī citu bioloģisko struktūru pašsapulcē. Elektrostatisko saišu enerģijas īpatsvars savienojošo molekulu mijiedarbības enerģijas kopējā daudzumā, iespējams, ir mazs. Būtiskākas molekulu savienošanai ir "hidrofobās" saites. Bet jonu grupas var paātrināt pašapvienošanos. Elektrostatiskie lādiņi var mijiedarboties salīdzinoši lielā attālumā. Un tieši viņu darbības lielā attālumā, iespējams, ļauj "izpētīt" vidi, atpazīt vēlamo partneri un ar viņu orientēties. Tas liek domāt, ka, saliekot ļoti sarežģītas struktūras, kas notiek vairākos posmos, jādarbojas arī tādiem specifiskiem enzīmiem kā trombīns.Ir viegli iedomāties šādu reakciju secību: prekursora proteīns, kas paredzēts, piemēram, piedalīties divās montāžas reakcijās, tiek aktivizēts ar pirmo fermentu un apvienojas ar noteiktu partneri; tas padara to pieejamu otrajam fermentam un tam sekojošai specifiskai otrā partnera piesaistei. Iespējams, ka tieši tas ir to bioloģisko struktūru organizēšanas mehānisms, kuru sarežģītība izslēdz tiešas pašsapulces iespēju. Sarežģītu struktūru montāžas starpposmos fermenti var būt ne tikai aktivizācijas rīki. To darbība var mainīt olbaltumvielu vispārējās īpašības. Piemēram, noteikts proteīns, kas jau ir “iestrādāts” struktūrā, var kļūt par tā nešķīstošo daļu, pateicoties fermentiem zaudējot ievērojamu daļu hidrofilo komponentu. Protams, šāda shēma neizslēdz citus, kas nozīmē nesēju olbaltumvielu esamību, kas piegādā nešķīstošus proteīnus montāžas vietā. Noslēgumā jāatzīmē, ka supramolekulāro bioloģisko struktūru montāžas procesu izpēte ir lauks, kas piepildīts ar neskaidriem un sarežģītiem jautājumiem. Tāpēc šajā attīstības stadijā informācija par procesiem, kas notiek tādās salīdzinoši vienkāršās sistēmās kā fibrīna šķiedru veidošanās sistēma, ir īpaši interesanta un noderīga. V. Belitsers
|
| Informācijas fizioloģiskā divdimensionālība: mehānismi un sekas | Pārbaude ar L-Dopa |
|---|
Jaunas receptes
 Mūsdienu bioloģija ir dziļi iekļuvusi šūnas - dzīvo “ķieģeļu” - dziļumos. Dzīvā šūna zinātniekiem parādījās kā harmonisku vienkāršāku struktūru kombinācija - membrānas, caurules, granulas, šķiedru veidojumi, kas sastāv no sakārtotām molekulām, kas savienotas viena ar otru.
Mūsdienu bioloģija ir dziļi iekļuvusi šūnas - dzīvo “ķieģeļu” - dziļumos. Dzīvā šūna zinātniekiem parādījās kā harmonisku vienkāršāku struktūru kombinācija - membrānas, caurules, granulas, šķiedru veidojumi, kas sastāv no sakārtotām molekulām, kas savienotas viena ar otru.